いまさら聞けない基礎用語!【キ】#019 気液平衡
公開日時:2023/03/15
気と液が平衡・・・ってどういうこと?
みなさん、こんにちは。基礎用語、案内役のあるるです。
今月注目する基礎用語はコチラ!!
↓↓↓
今月の基礎用語:キ #019
気液平衡(きえきへいこう)
博士「おーい、あるる、お湯が沸いておるぞ〜」
あるる「ああっ!!ほんとだ! スマホに夢中で気づきませんでした」
博士「危ないのぅ。これからは、お湯を沸かすときにはスマホ禁止じゃな」
あるる「・・・はい・・・ごめんなさい・・・(深く反省)・・・」
博士「わかればよろしい。同じことを繰り返さないことが大切じゃ」
あるる「はいっ! もう2度としません!! では、お茶を淹れますね・・・って、あれ? やかんが軽っ! お湯が少ししか入ってないや」
博士「ほったらかしている間に、蒸発してしまったのじゃろう。のんびり待っておるから、もう一度お湯を沸かしておくれ」
あるる「はい。そういえば、以前もこうしてやかんの前で、水蒸気と湯気の違いを教えてもらいましたねぇ」
博士「ん? そうじゃったか?」
あるる「えー? 忘れちゃったんですか? その時『水蒸気と湯気の違いがわかると、かなりカッコ良い』と言われたんですよ〜」
博士「・・・(思い出せない)・・・」
あるる「もう、博士ったら! じゃ、一緒に復習しますよ! 終わるまでお茶は出しません!」
博士「ええーーー・・・・」
気液平衡とは?
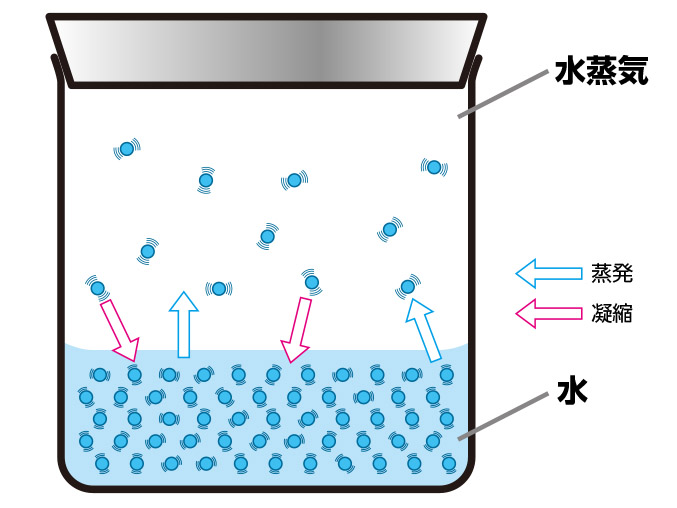
液体の表面では絶えず「蒸発」が起こっています。
これは液体分子が激しく振動しているなかで、他の分子との引力にうちかって液面から飛び出すからです。
温度が上がると分子の振動は激しさを増し、蒸発する分子が増加します。
したがって、液体が密封容器に入っている場合、気相の分子の密度が増します。気体分子の中には液面に衝突して液体内に入るものもありますが、この衝突回数は圧力に比例します。
単位時間内に液体から気体に飛び出す分子と、気体から液体に戻る分子の数が等しいとき、見かけ上、状態の変化は見られなくなります。この液体と気体が共存している状態を「気液平衡(きえきへいこう)」と言います。
そして、この時の気体の圧力が飽和水蒸気圧です。
飽和蒸気圧が外気圧に等しくなると、蒸発は急激に活発になり、液体の表面からだけではなく内部からも気化が起こります。
これが沸騰であり、気体と液体が共存して温度が一定に保たれ、この時の温度が沸点です。
気液平衡:見かけ上、蒸発も凝縮も起こっていない状態
飽和水蒸気圧をもうちょっと深掘り
さきほど、気液平衡する時の気体の圧力が飽和水蒸気圧だと申しました。
気温が高くなると飽和水蒸気圧(飽和水蒸気量)は高くなり、100℃になると1013.25hPa になります。
つまり水蒸気のみで1気圧になるわけです。
やかんでお湯を沸かしたときに、沸騰して注ぎ口から噴き出している透明の部分が水蒸気です。
水蒸気はすぐに外気で冷却され飽和水蒸気圧が下がるため、水滴となって水蒸気との混相となったものが湯気です。
水滴となったために目視できるのです。
水蒸気分圧
100℃では水蒸気のみで1気圧(1013.25hPa)になりましたが、そもそも空気は色々な気体の混合体であり、それぞれの気体の圧力の総和が大気圧となります。
水蒸気量(g/m3・立米)も水蒸気分圧(hPa)も表していることは同じなのですが、ここで〝分圧(=水蒸気分圧)〟という考え方が重要になります。
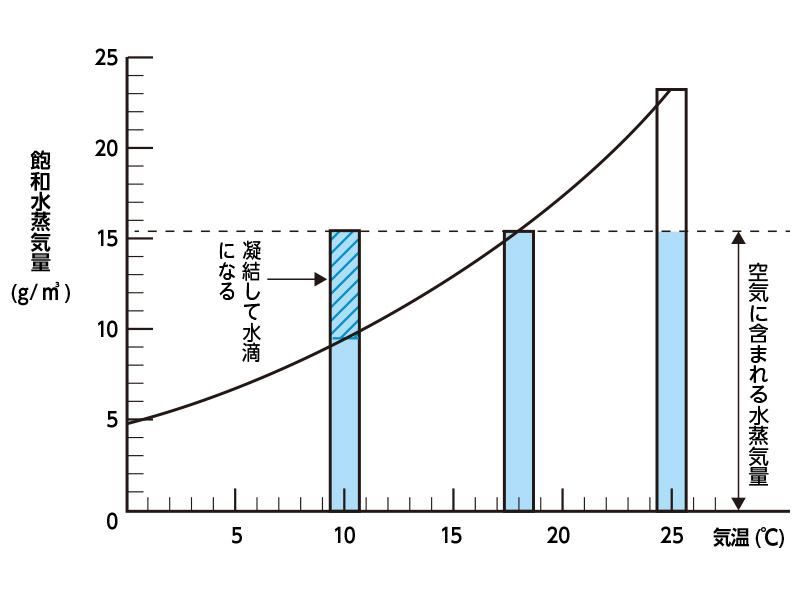
例えば、気温25℃、1気圧で露点温度18℃の湿り空気(水蒸気を含んだ空気)があるとします。
露点温度18℃の飽和水蒸気量は15.4g/m3であり、飽和水蒸気圧は20.6hPaです。
そして空気の分圧は、標準大気圧1atm=1013.25hPaなので、
1013.25-20.6=992.65(hPa)となります。
複数の圧力を合わせて1気圧というと違和感があると思いますが、この場合の「分圧」は、1m3(立米)の容器に15.4gの水蒸気のみがあった場合、その容器の内圧が20.6hPa になるという事です。