【今月のまめ知識 第27回】圧力とは?
公開日時:2015/06/19
あるる「博士ぇ〜。そろそろ暑くなってきたので、カレーを作ってきましたー! 一緒に食べましょう!」
博士 「おっ、珍しいこともあるもんじゃ。ではありがたく頂くとしよう」
博士・あるる 「いただきま〜す」
博士 「ん?? なんだこのジャガイモ、まだ芯が硬いぞ・・・」
あるる 「えーー?!(パクッ)。あ〜、ホントだ・・・。この前煮すぎてジャガイモがドロドロに溶けちゃっから、今回はキレイに仕上げようと思って・・・」
博士「早く火を止めたんじゃな。ちょっと気が早かったのぅ」
博士「そうじゃ。あるる。短時間でキレイに煮る方法があるんじゃが、知っとるかな?」
あるる「えっ? 魔法?」
博士「そんなわけなかろうて。正解は、“圧力鍋”じゃよ」
あるる 「圧力鍋って、あの重た〜い鍋ですよね」
博士 「そうじゃ。圧力鍋は高温で調理できるから、短時間で美味しく作れるぞ。
しかも、光熱費の節約にもなるんじゃ」
あるる 「へぇ〜。いいなぁ〜、圧力鍋。欲しいなぁ〜。
あるる「でも博士、なんで高温になるんですか?」
博士 「それは、圧力鍋だからじゃよ。」
あるる 「・・・ (-_-) はーかーせー」
博士 「おお、すまんすまん。実は圧力と温度は密接な関係があるんじゃよ。
よし、ちょうど良い機会じゃ。今日は圧力について勉強するとしよう」

これまで2回にわたり「熱」についてお話しました。
その中で、我々が通常使用している温度の単位は「摂氏」(℃)であること。
そしてもともとの定義は、「1気圧における水の凝固点を0 ℃、沸点を100 ℃としたもの」
だとご説明しました。
気圧とは「気体の圧力」のことです。
地球をとりまいている大気、空気の重さによって生じる圧力で、「大気圧」とも言います。
今回は、この「圧力」についてお話しましょう。
本題に入るまでに、少しおさらいです。
気体の圧力の根源は、分子の熱運動ですので、熱運動の運動エネルギーが大きいほど
(=温度が高いほど)気体の圧力は大きくなります。
また、分子の数が多いほど気体の圧力は大きくなります。
気圧の他にも水の圧力が「水圧」、油の圧力が「油圧」など、
私たちの身の回りではいろんな物質の圧力が利用されています。
圧力とは
まず圧力といえば、最初に出てくるのが「パスカルの原理」です。
これは流体が密閉容器の中に入れられていて、各分子が静止している場合、
あらゆる地点の圧力は等しくなるということです。
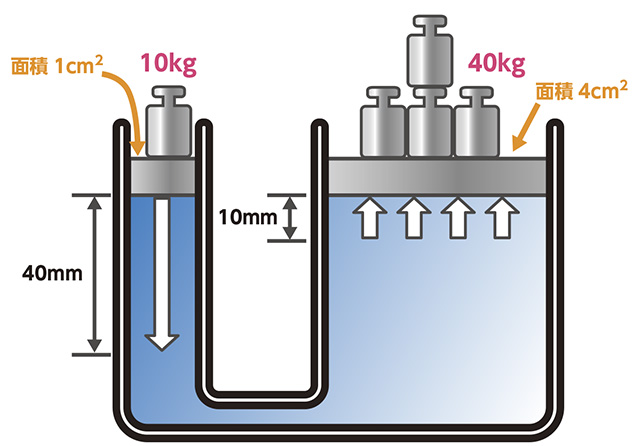
パスカルの原理
圧力とは単位面積あたりにかかる力のことで、SI単位ではPa(パスカル)です。
1Pa = 1N/m2 なので、
1Paとは1m角の面に1N(約0.102kgf)の力が掛かっているということです。
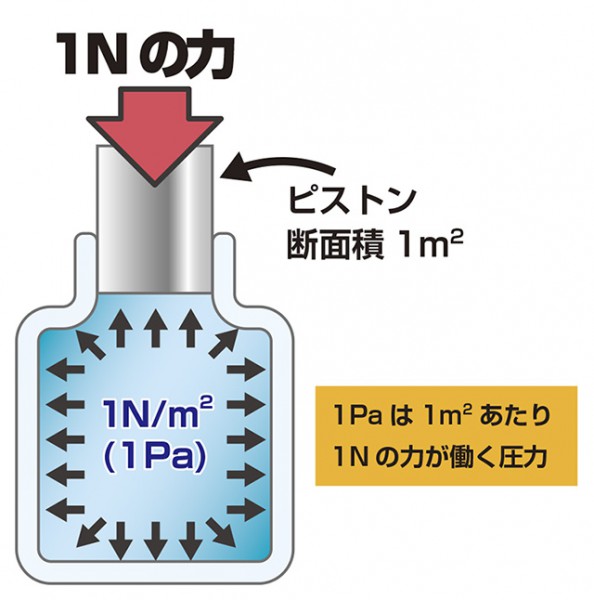
手のひらに物を載せた時に、同じ質量のものでも
接触面が小さいと圧力は大きくなります。
固体の場合には、圧力は接触している一方向からのみですが、
流体の場合は接触している全方向からかかります。
今回は、流体の圧力についてお話ししたいと思います。
2種類の圧力 絶対圧とゲージ圧
圧力には 絶対圧 と ゲージ圧 があり、単位は、Mpa(メガパスカル)です。
[※ M(メガ)は接頭語で106を表す]
絶対圧の場合は、AまたはAbs、
ゲージ圧の場合はGまたはGaugeなどの
添え字を単位記号の後に用いて区別しています。
絶対圧は「0」が絶対真空です。
天気予報で言われる気圧は絶対圧であり、負圧はありません。
ゲージ圧は大気圧を「0」としたものです。
大気圧との差圧であり、負圧があります。
圧縮空気の圧力や水圧、油圧などはゲージ圧で表しています。
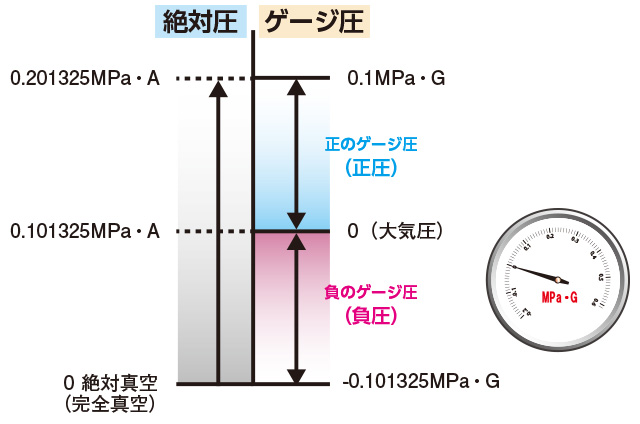
標準大気圧は絶対圧
標準大気圧は絶対圧です。
101,325Pa=1,013.25hPaと決められており、
これがいわゆる1気圧です。
[※ h(ヘクト)は接頭語で102を表します]
1気圧は地上において、その上にある空気の重さです。
日常ではあまり感じませんが、空気にも重さがあり、わたしたちはいつも空気に押されています。
空気の質量は0℃、1気圧で1.293kg/m3と非常に軽いものですが、
地表面に高く積みあがっているので
地表では1m2当り約10トン(1cm2当り約1kg)もの力が
すべての方向から掛かっています。
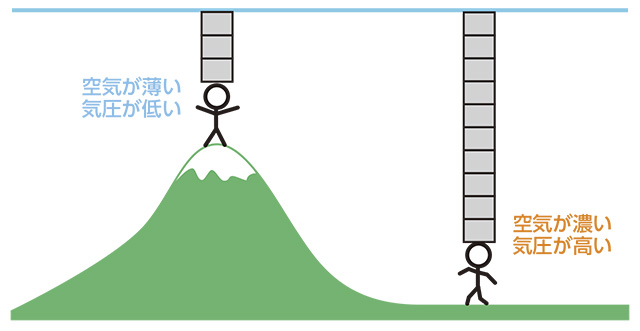
また、気圧は空気の重さによる圧力ですから、
緯度や高度により変化します。
高い山へ行くと気圧が低くなるのは、上にある空気の量が少なくなるからです。
我々が圧力計で見るのはゲージ圧になりますが、
ベースとなる大気圧は絶対圧で0.1MPaになります。
(場所により異なりますが、微差なのでゲージ圧を考える時は誤差と見なして0.1MPa)
絶対圧は、ゲージ圧と大気圧の和になるので、
ゲージ圧で0.3MPaは、絶対圧で0.4MPaになります。
0.4MPa(絶対圧力)=0.3MPa(ゲージ圧)+0.1MPa(大気圧)
温度が同じであれば、ゲージ圧0.3MPaの圧縮空気は大気に対して
体積が1/4になっているわけです。
気体の体積変化
気体には、その種類に関係なく、「圧力と体積と温度」の間に
一定の関係があります。
気体の体積が圧力、温度、物質量によってどの様に変化するか、
その法則性についてお話しましょう。
ボイルの法則
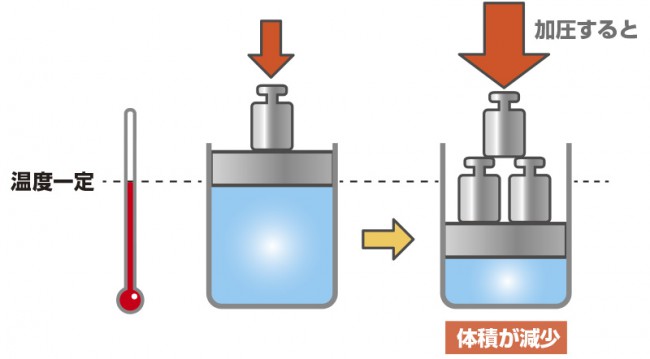
ボイルの法則とは、一定温度下での体積と圧力の関係です。
ボイルの法則:温度と質量が一定のとき、
気体の圧力p は体積V に反比例する
pV=k(一定)
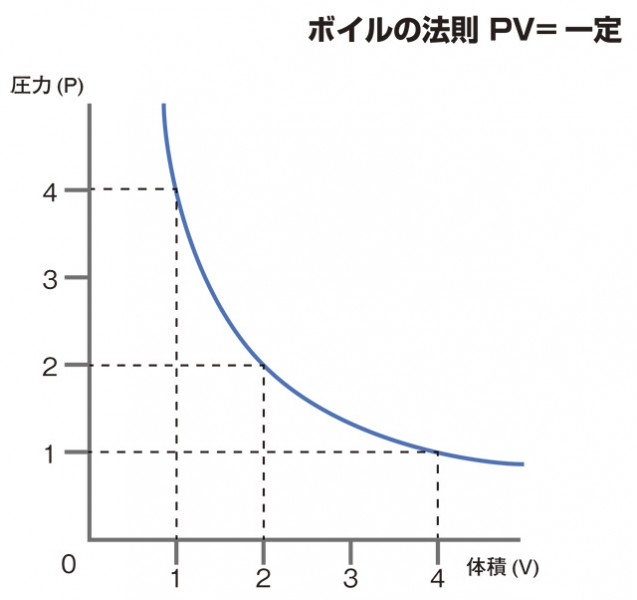
これは体積を1/2にすると、単位体積当たりの分子数が2倍になり、
単位時間あたりの分子の衝突回数が2倍になる、
つまり圧力が2倍になるということを言っています。
気体の圧力とは分子の単位時間当たり、単位面積当たりの衝突回数なのです。
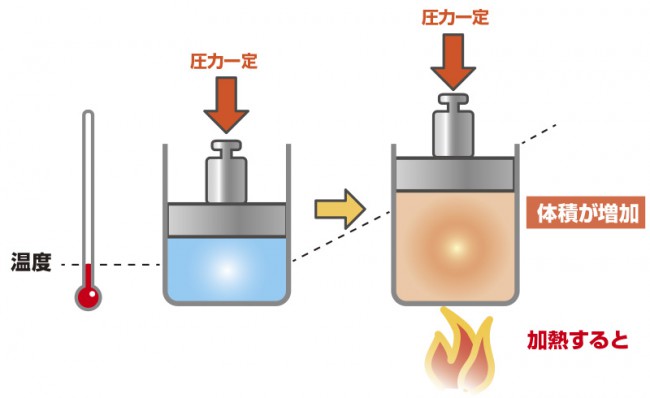
シャルルの法則
シャルルの法則とは、一定圧力下での体積と温度の関係です。
シャルルの法則:圧力と質量が一定のとき、
気体の絶対温度T は体積V に比例する
V/T=k(一定)
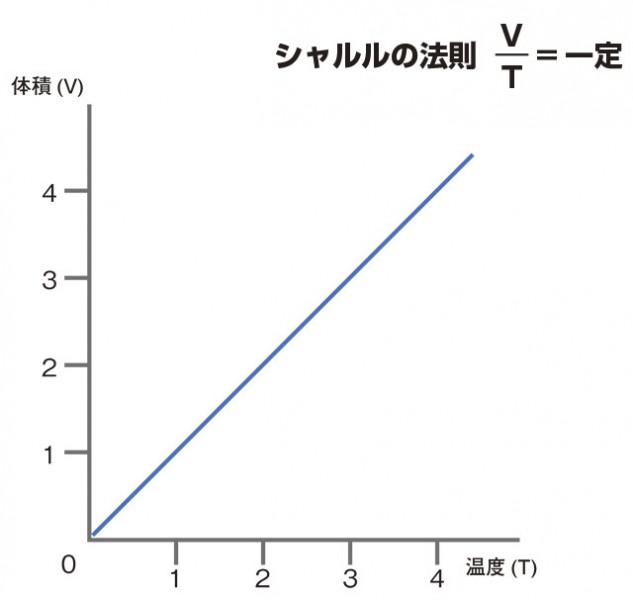
これは温度が上昇すると分子の運動が激しくなり、体積が増加するということです。
圧力が一定のとき、一定量の気体の温度を1℃変化させると、
体積は0℃のときの体積の1/273だけ増加(減少)することになります。
ボイル・シャルルの法則
ボイルの法則とシャルルの法則を組み合わせると、
圧力と温度が同時に変化した時の関係を導くことができます。

ボイル・シャルルの法則:質量が一定のとき、
気体の体積V は圧力p に反比例し、
絶対温度T に比例する
pV/T=k(一定)
つまり、気体の温度が上昇して、体積もそれに応じて増加すれば、圧力は変わりません。
しかし、密封容器内の気体を加熱した場合などは体積変化がないので
分子の運動が激しくなった分、衝突回数が増加し、圧力が高くなるということになります。
このように圧力、体積、温度は密接な関係にあるわけです。
※ボイル・シャルルの法則は理想気体という理論上の法則です。
実在の気体では、分子の大きさや分子間の相互作用により誤差が出ます。
特に低温や高温では誤差が大きくなります。
博士「どうじゃ、あるる。圧力と温度の関係、わかったかな?」
あるる「はい! 不思議なことに、鍋の中をイメージしながら話を聞いていたら、よーくわかりました」
あるる「要するに、圧力鍋は蒸気を密閉して逃さないようになっているから、鍋の中の圧力が上がる。だから沸騰温度も高くなって、短時間で煮えるんですね!」
博士「・・・正解・・・。珍しいこともあるもんじゃ・・・。あるるの食いしん坊がこんなところに役に立つとは(驚)」
あるる「すごいなぁ〜、圧力鍋! 早速買いに行きます!」
博士「(なんだこの決断力と行動力は・・・)で。何を作ってくれるんじゃ?」
あるる「まずはリベンジでジャガイモをゆでます! 後は、トウモロコシでしょ。ゆで卵でしょ。あー、今の季節な枝豆もいいなぁ〜。ソーセージも、あ、キャベツも茹でると甘くなるんだよねねぇ〜」
博士「おいおい、茹でてばっかりじゃないか」
あるる「え? だって「ボイル」するんでしょ。“アルル・ボイルの法則”ーーーなんちゃってぇ〜♪(にやり)」
博士「ふぉっふぉっふぉっ。最後の方、やけにニヤニヤしていたと思ったら、そんなことばかり考えいていたんじゃな。お願いだから、シチューとか肉じゃがとか、いろんな料理を作っておくれよぅ」