【今月のまめ知識 第25回】熱とは何か?
公開日時:2015/04/21
とある日のお昼時。
あるるがお弁当を「チン♪」しているところに博士がやってきた。
手にはもちろん、お弁当を持って…。
あるる「あ、博士もお弁当あっためるんですか? 結構マメなんですね」
博士「え、そうか? だって温めた方が美味しいからのぅ」
------ チン♪ --------
あるる「あっちっち。わー、今日も美味しそう (^o^)v」
あるる「でも、毎回不思議なんですよね。電子レンジってどうしてこんなに
熱くできるんでしょうか? 火もお湯も使ってないのに…」
博士「(にやり)良いところに気がついたな。電子レンジは、マイクロ波を照射して、
食品の中にある水分の分子をだな・・・」
あるる「わ〜、博士ぇ〜、説明は今じゃなくていいんですぅ〜。
せっかくあっためたお弁当が冷めちゃいますから続きは、午後の授業でお願いします!」
博士「なんじゃ、そうか(つまらんのぅ…)」
あるる「はい。もう、お腹べこべこです〜」
これまでに、アルミ(金属)は「熱伝導が良い」という特徴を持つとお話してきました。
熱伝導とは物質の移動を伴わずに、高温側から低温側へ熱が伝わる移動現象のひとつですが
この「熱」とはいったい何なのでしょう?
今回は、分かっているようで実は奥深い・・・そんな「熱」についてお話しましょう。
「熱」と「温度」の違い
まず「熱」と「温度」の違いについてです。
「熱」とはエネルギーであり、
「温度」とは熱さ、冷たさを数値化して表したものです。
この熱のエネルギー量を「熱量」といい、単位は[J]ジュール(昔は[cal]カロリー)で表します。
一方、我々が通常使用している温度の単位は「摂氏」(℃)です。
これは「ケルビン(K)で表した熱力学温度(絶対温度)の値から
273.15を減じたもの」で、もともとの定義は、
1気圧における水の凝固点を0 ℃、沸点を100 ℃としたものです。
熱力学温度のケルビン(K)とは、分子の運動が止まった状態
(実際には完全に止まることはありませんが)の温度を
0(ゼロ) Kとしたものです。
熱のエネルギー
【今月のまめ知識 第23回】金属とは何か?では、
自然界に存在する物質は「分子」や「イオン」の集合体で、
分子は「原子」が集まってできているものとお話しました。
その分子(原子)は、すべて乱雑な運動(熱運動)をしており、
この運動エネルギーの大きさが熱の大きさになっているのです。
すなわち、
熱のエネルギーとは、分子(原子)の運動エネルギーなのです。
身近なところで言うと、電子レンジです。
電子レンジは火も使わずに食品を加熱することができますが、
これはマイクロ波を照射して、食品の内部にある水の分子を激しく振動・回転させる
わけです。
物質の3態
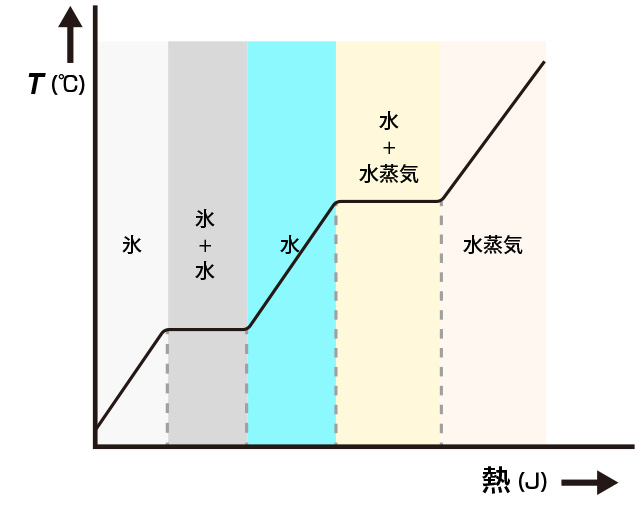
物質の状態には、固体,液体,気体の3態があり、
それぞれの状態で熱運動の様子が異なります。
これを水で考えてみましょう。
●固体の状態は・・・「氷」
分子同士は分子間力で結びつき、形を保っていますが、各分子はその場所で振動しています。
●液体の状態は・・・「水」
分子の振動が激しくなり、分子間力が弱まるため、各分子の位置は自由に動きます。
ただし分子間力により引き合って距離を保っているのと、大気圧が蓋の役割をして押さえつけているので
外へ飛び出すことはありません。
●気体の状態は・・・「蒸気」
さらに分子の振動が激しくなり、分子間力がほとんどなくなり、各分子は自由に動き回ります。
そして大気圧に打ち勝って分子間の距離が大きくなり、体積が膨張して気体となって飛び出す状態が「沸騰」です。
水は1気圧において100 ℃で沸騰しますが、高い山へ行くと100 ℃以下で沸騰します。
これは気圧が低くなり、激しく振動して動き回る分子を押さえる力が弱く成るためです。
熱平衡と潜熱
また、異なる温度の物質を接触させると、熱をやり取りして等しい温度になります。
熱をやり取りできる状態にありながら、何の状態変化も起こらないこの状態を
“熱平衡”といいます。
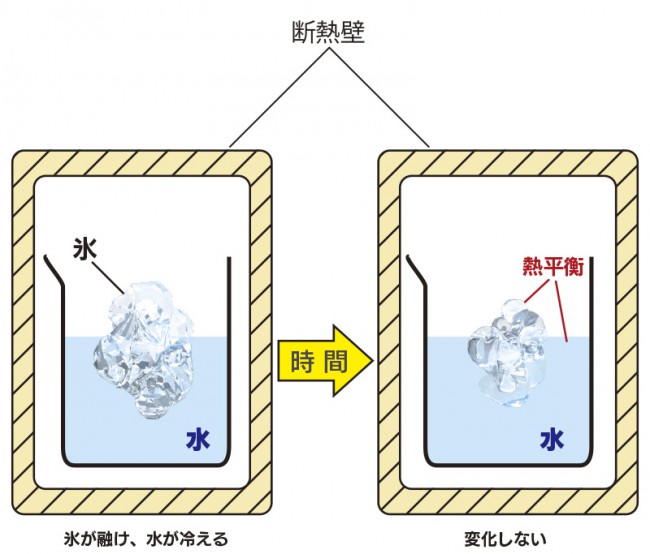
断熱壁で覆われ外部から熱が加わらない状態
断熱壁を取り除き、外部から熱を加えても、温度変化が起こらない状態があります。
これは相が変化するときで、
固体→液体へ変化するときの熱エネルギーを「融解熱」
液体→気体へ変化するときの熱エネルギーを「気化熱」
これらを合わせて、“潜熱”と呼びます。
上図の、氷と水が熱平衡となった状態は0 ℃ですが、
ここで外部から熱しても、氷がなくなるまでは0 ℃です。気化する時も同様です。
お湯で手を洗っても拭かずに放っておくと冷えてきますが、しばらくすると水が蒸発していきます。
これは手のひらから熱エネルギーを奪っていく「気化熱」によるものです。
表面の分子が他の分子との衝突で運動エネルギーをもらい飛び出していくためで、
もとの塊の運動エネルギーが減るため、温度が下がるわけです。
熱力学の法則
熱には、第0、第1、第2、第3から成る基本法則があり
代表的な法則は“第一法則” “第二法則”です。
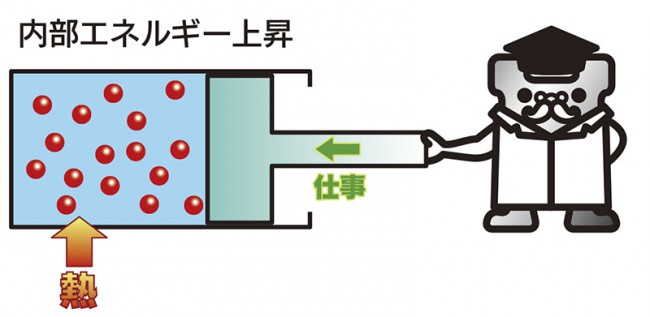
熱力学の第一法則
物体に熱を与えたり、仕事をしたり(圧縮など)すると、物体の内部エネルギーは増加します。
加熱したり圧縮したりすると、温度が上昇するというでことす。
そのエネルギーの総和は増えも減りもせず一定です。
ですから、何もないところからエネルギーを生み出すことは出来ません。
これが“熱力学の第一法則”(エネルギー保存の法則)です。
自動車は、ガソリンという化学エネルギーを運動エネルギーに変換しているのですが、
熱力学の第一法則は、与えるエネルギーが無ければ車を走らせることは出来ない
(第一種永久機関は存在しない)ということを言っています。
熱力学の第二法則
温度差のある物体を接触させると、高温の方から低温の方へと熱伝導が起こります。
高温側の激しく振動している分子の運動が低温側へ伝わるということです。
低温側から高温側へ熱が移動することはありません。
何を常識的なことを物々しい表現でと思われるかもしれませんが、
これは熱エネルギーの不可逆性(一方通行である事)を言っており、
使った熱エネルギーを完全に回収して再利用することは出来ません。
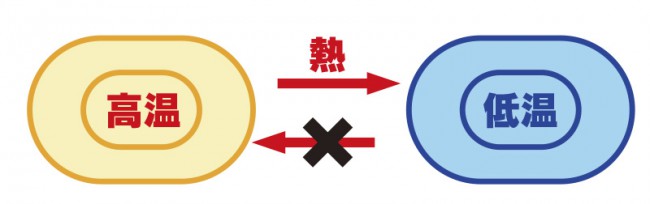
これが“熱力学の第二法則(エントロピーの法則)”です。
先ほど自動車はガソリンという化学エネルギーを運動エネルギーに変換していると言いましたが、
運動エネルギーは機械的な摩擦、タイヤと路面の摩擦、ボディーと空気の摩擦など熱に変わっていき、
減速のためにブレーキをかけるとこれも熱エネルギーに変わります。
熱力学の第二法則は、これらの熱エネルギーを完全に回収して再利用することは出来ない
(第二種永久機関は存在しない)ということを言っています。
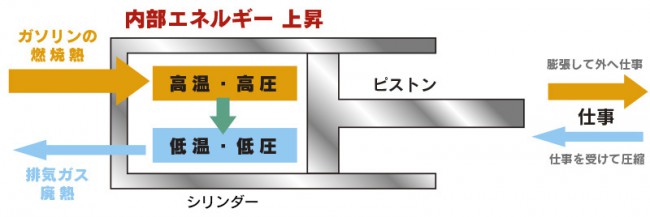
こういう、もとに戻らない変化を不可逆的変化と言います。
「覆水盆に返らず」という事です。
このようにすべてのエネルギーは、最後には熱エネルギーとなり無秩序になって放出されていきます。
この無秩序さが増加することを、エントロピーが増大すると言います。
(断熱系ではエントロピーは増大し続けます。興味のある方は
「エントロピーの増大」や「マクスウェルの悪魔」で検索してみてください)
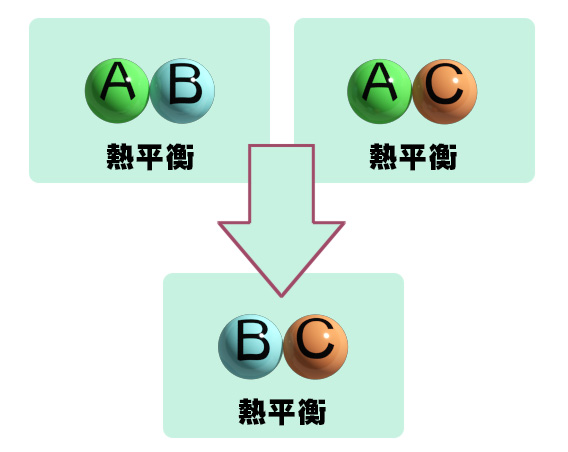
熱力学の第0法則
物体AとB、物体AとCが熱平衡ならば、物体BとCも熱平衡であるという事が
“熱力学の第零法則”です。
常識的に当たり前のことですが、これを基に温度というものが定義されています。
熱力学の第三法則
最後にすべての物質は、零K (絶対零度)でエントロピーが零になるという
“熱力学の第三法則”があります。
エントロピーとは色々な分野で使われていて、それぞれ異なった意味合いを持ちますが、
総じて「無秩序さの程度」という概念です。
零 Kで分子の運動も止まれば、運動しているという無秩序さがなくなり、
すべての物質で同じような状態になることから、熱力学の基準点として考えられています。
『熱い』『冷たい』という、私たちの生活の中で非常に慣れ親しんだ「熱」ですが、
改めて考えてみるとなかなか難しいものです。
異なる物質をどうして同じ温度だと言えるのか?
熱の正体は何なのか?
まとめると
・分子の運動エネルギーの大きさである
・エネルギーの総量は一定である(第一法則)
・熱は不可逆性を持っている(第二法則)
ということがおわりになったでしょうか。
博士「と、いうことじゃ。あるるよ、「熱」がなんだかわかったかな?」
あるる「・・・・・・」
博士「どうした、あるる。やけにおとなしいじゃないか?」
あるる「今、咀嚼してるんです。えっと、えっと、第一法則があれで・・・」
博士「おや? あるる、 顔がちょっと赤くないか?」
博士「(あるるのおでこに手を当てて)熱い! あるる、熱があるぞ」
あるる「え? そうですか? なんだかカラダが熱いなぁ〜とは思っていたんですが…」
博士「ふぉっほっほっ。熱について勉強したら、あるるが発熱するとはのぅ。やってくれるのぅ(笑)」
あるる「もう、博士ったら・・・笑いごとじゃないですよ!」
博士「こりゃ、知恵熱じゃよ。今日はもう帰って、休むがいいぞ。お大事にな」
